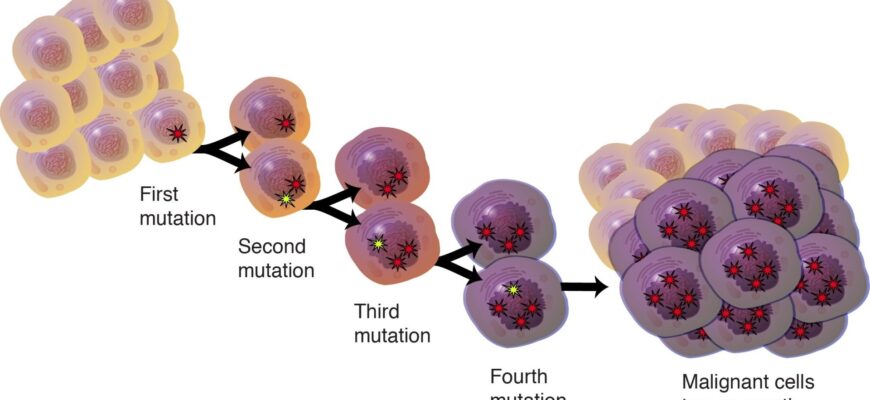
Глубокое понимание молекулярных основ развития заболеваний на уровне ДНК открывает новые горизонты в терапии. Секвенирование следующего поколения (NGS) становится стандартным инструментом диагностики, позволяя накапливать всё больше данных о геноме опухолевых клеток.
На вопросы «Ъ-Науки» о природе онкологических заболеваний, методах диагностики и лечения ответил заведующий кафедрой онкогенетики Института высшего и дополнительного профессионального образования Медико-генетического научного центра им. академика Н. П. Бочкова, ведущий научный сотрудник лаборатории эпигенетики МГНЦ, к.м.н. Дмитрий Михайленко.
Генетические стражи
— Почему возникают злокачественные новообразования?
— Ученые осознали, что рак — это заболевание, затрагивающее геном, еще в прошлом веке, и современные исследования лишь подтверждают этот вывод. Клетки нашего тела следуют строгим правилам роста и деления, регулируемым клеточным циклом. Этот цикл включает период между делениями, когда клетка выполняет свои специализированные функции. В человеческом геноме есть небольшая группа генов — протоонкогены и гены-супрессоры — которые критически важны для контроля деления. Протоонкогены активируют деление клеток, когда это необходимо, например, для восстановления тканей после травмы или в процессе эмбрионального развития. Гены-супрессоры, или «стражи генома», напротив, включают механизмы торможения деления. Перед каждым делением специальные клеточные системы проверяют целостность генома. При обнаружении критического числа повреждений клетка должна быть уничтожена через программируемую смерть (апоптоз). Ген TP53 является одним из ключевых регуляторов этого процесса, предотвращая бесконтрольное размножение клеток с ошибками. Копирование генома перед делением — чрезвычайно сложная задача: за несколько часов нужно точно воспроизвести более 3 миллиардов пар нуклеотидов. Ошибки, или мутации, при этом неизбежны, подобно попытке без ошибок переписать огромную библиотеку за короткий срок. Некоторые мутации активируют рецепторы или другие молекулы, толкая клетку к опухолевому росту. Однако одного такого шага недостаточно для развития рака. Если бы не система репарации ДНК, выработанная в ходе эволюции, количество ошибок быстро стало бы критическим. Репарация значительно снижает частоту мутаций, но не устраняет их полностью. Некоторые мутации безвредны и даже способствуют нашему биологическому разнообразию. Но изменения в генах, контролирующих клеточный цикл, ведут прямо к канцерогенезу — опухолевому процессу. Рак возникает из-за накопления мутаций. Одни превращают протоонкогены в активные онкогены, стимулирующие безудержное деление. Другие повреждают гены-супрессоры, лишая их способности тормозить клеточный цикл. В результате появляются клетки, действующие как независимые организмы внутри тела. Они активно стимулируют рост сосудов для своего питания, разрушают соседние ткани и распространяются в другие органы, формируя метастазы.
Как опухоль эволюционирует
— Опухоль меняется по мере развития?
— Структура опухоли значительно сложнее, чем просто скопление мутировавших клеток. Новообразование создает вокруг себя микроокружение из клеток, выделяющих факторы роста, что ускоряет пролиферацию опухолевых клеток. Со временем опухолевые клетки приобретают новые функции, необходимые для инвазии — разрушения соседних структур. Они начинают продуцировать ферменты, разрушающие базальные мембраны. Затем появляются субклоны клеток, способные покидать первичный очаг и распространяться по кровотоку или лимфе, образуя метастазы. Метастазы могут существенно отличаться от первичной опухоли, что затрудняет их диагностику и определение исходного типа рака, иногда даже с помощью иммуногистохимии. Такие случаи классифицируют как «опухоли из невыявленного первичного очага». Для формирования метастазов необходимы развитая сосудистая сеть и подходящее тканевое микроокружение, поэтому они часто обнаруживаются в печени, легких, мозге, костях. В процессе роста опухоль также эволюционирует, приобретая более агрессивные свойства. Клетки могут терять характеристики исходного тканевого типа (дедифференцировка) и начинать продуцировать нетипичные белки, что также усложняет диагностику. Происходит своего рода «эволюционный отбор» внутри опухоли. Клетки с «выгодными» для выживания и роста мутациями (драйверными мутациями), позволяющими ускользать от терапии, становятся доминирующими и определяют поведение всей опухоли.
Достижения в диагностике
— Есть ли ощутимый прогресс в рутинной генетической диагностике онкозаболеваний в России?
— Да, безусловно, и весьма значительный. В настоящее время расширяется ассортимент диагностических панелей NGS, позволяющих проводить точный молекулярный анализ генома опухоли. Это огромное преимущество для пациентов, поскольку от точности диагноза напрямую зависит эффективность назначенного лечения. Новые панели охватывают все большее число генов. Важно отметить, что появились отечественные разработки, делающие такую диагностику более доступной. В совокупности это способствует более широкому применению методов онкогенетики в рамках системы ОМС. Например, если ранее по ОМС секвенирование ограничивалось генами BRCA1 и BRCA2, то с конца 2024 года NGS включен в тарифы для выявления мутаций при раке легкого, что позволяет более точно подобрать таргетную терапию.
Иммунитет против рака: как научить его распознавать опухоль
— Сегодня активно обсуждается иммунотерапия рака. Какие генетические аспекты здесь важны?
— Нашей иммунной системе очень трудно распознать опухолевую угрозу, особенно на ранних стадиях. Опухоль развивается из наших собственных клеток, поэтому поверхностные белки опухолевых клеток изначально схожи с нормальными, и иммунный ответ может быть слабым. Иммунная система лучше распознает опухоль, когда на ее поверхности появляются уникальные опухолевые неоантигены — молекулы, отсутствующие в здоровых клетках. Главная цель иммунотерапии — помочь иммунитету «увидеть» и атаковать опухоль. Развитие этого направления началось давно. В 1970-е годы были изучены иммунологические механизмы, роль интерлейкинов и интерферонов, появились первые попытки использовать цитокины против рака. Однако эффективность первых препаратов была невысокой из-за значительных побочных эффектов. Поэтому к началу 2000-х иммунотерапия уступала по эффективности химио-, лучевой и таргетной терапии. Но исследования продолжались. Прорыв произошел с открытием механизма, который опухолевые клетки используют для подавления иммунного ответа. Это естественное взаимодействие в организме (система сдержек и противовесов) предотвращает чрезмерную активацию иммунитета и повреждение здоровых тканей. Клетки могут тормозить активность Т-лимфоцитов через взаимодействие молекул PD-1 и PD-L1. Опухолевые клетки используют этот же механизм: выставляя на своей поверхности PD-L1, они «отключают» Т-лимфоциты, не давая им атаковать. Понимание этого процесса позволило разработать ингибиторы иммунных контрольных точек. Эти препараты блокируют взаимодействие PD-1/PD-L1, позволяя Т-лимфоцитам эффективно уничтожать опухолевые клетки. Сегодня в мире и в России применяются такие ингибиторы, значительно увеличивающие продолжительность жизни пациентов. Они эффективны при многих типах рака, особенно при карциномах (рак желудка, молочной железы, колоректальный рак, рак легкого), а также при меланоме. Эффективность зависит от типа опухоли, поэтому препараты назначаются по строгим показаниям. Ингибиторы могут быть спасением для пациентов, не ответивших на стандартные линии терапии. С точки зрения генетика важно, что назначение ингибиторов иммунных точек основано на лабораторных данных об их потенциальной эффективности. Первое показание — повышенная экспрессия PD-L1, определяемая методом иммуногистохимии. Второе — молекулярно-генетические маркеры геномной нестабильности опухоли, свидетельствующие о большом количестве неоантигенов. Это тесты на микросателлитную нестабильность (MSI) и мутационную нагрузку (TMB). Для назначения препарата требуется выявить MSI или TMB более 10 мутаций на 1 млн пар нуклеотидов в исследованных генах.
Нужно ли полное секвенирование генома опухоли?
— Необходимо ли при диагностике полностью исследовать геном опухоли?
— Ценность полного генетического профилирования опухолей методом NGS возрастает. Однако, как и любое тестирование, оно имеет свои показания. Нецелесообразно проходить генетические тесты без консультации специалиста. Стоимость NGS постоянно снижается, и сейчас активно обсуждается, как ускорить диагностический процесс. Можно проводить иммуногистохимический анализ параллельно с секвенированием большой панели генов, интегрировать эти данные и принимать обоснованные решения о терапии. На поздних стадиях, например при раке легкого, нет времени на последовательные исследования: целесообразно сразу сделать обширную генетическую панель для выявления всех ключевых мутаций. Крайне важно правильно интерпретировать и применять генетические данные в клинической практике. Сегодня главная задача не столько провести секвенирование, сколько грамотно обработать и аннотировать данные, понять их клиническое значение и принять правильное терапевтическое решение. До сих пор нет единого международного консенсуса по классификации клинической значимости соматических мутаций, возникающих в опухолевых клетках. На мой взгляд, разработка эффективных критериев оценки клинической значимости мутаций в онкологии является одной из ключевых задач на сегодня.
Возможно ли победить рак?
— Можно ли в принципе победить рак, чтобы он исчез, как некоторые инфекционные болезни?
— Человечество не сможет полностью избавиться от онкологических заболеваний. Рак, по сути, является частью процесса старения — результатом естественных изменений в клетках. Опухолевые клетки происходят из нормальных, в которых накопились мутации в течение жизни. Поэтому каждый человек имеет риск столкнуться с раком в определенном возрасте. Важнее спросить себя: что мы можем сделать для снижения этого риска? Мы не можем остановить мутации при копировании ДНК, но можем устранить факторы, способствующие их накоплению. Самое очевидное, хоть и банальное, — отказаться от курения. Повышенный риск также связан с вредными условиями труда. Кроме того, важно знать о наследственной предрасположенности. Возможно, в будущем секвенирование всего генома в раннем возрасте станет доступным, но пока это перспектива. Особую онконастороженность должны проявлять люди с отягощенным семейным анамнезом онкологических заболеваний. Им следует проконсультироваться с онкологом или генетиком и, по назначению врача, пройти обследование для выявления наследственного онкологического синдрома. Ранее считалось, что наследственные синдромы составляют не более 1% случаев рака, но благодаря NGS сегодня известно, что их вклад достигает 10%. При выявлении конкретной наследственной мутации пациенту показано регулярное обследование органов-мишеней (например, МРТ) в дополнение к стандартной диспансеризации. Сегодня мы понимаем, что рак — это не обязательно смертный приговор, а заболевание, с которым можно и нужно бороться. Арсенал методов лечения значительно вырос, и на первый план выходит ранняя диагностика. Если опухоль выявлена на поздней стадии, часто возможно хирургическое удаление первичного очага, а затем борьба с рецидивами и метастазами с помощью комбинированной терапии. При грамотном подборе лечения, позволяющего сохранить качество жизни, можно существенно увеличить ее продолжительность. Например, в онкоурологии успешно применяется комбинированный подход. Рак предстательной железы — одно из самых распространенных онкологических заболеваний у мужчин. На ранних этапах эффективно лечение, блокирующее сигнальный путь андрогенового рецептора. Если заболевание прогрессирует, применяют препараты других классов, воздействующие на иные мишени. Такой многоступенчатый подход дает очень хорошие результаты. Главное — не пренебрегать регулярными обследованиями и выявлять патологию как можно раньше.
Прикладная генетика в онкологии: что дальше?
— Что будет ключевым в ближайшем будущем для практической генетической диагностики онкологических пациентов?
— Помимо поиска новых диагностических и терапевтических решений, важно развивать комбинированные подходы таргетной и химиотерапии, которые могут быть эффективны для определенных групп пациентов. Необходимо постоянное совершенствование молекулярно-генетической диагностики. Рассмотрим пример рака предстательной железы. Изначально опухоль обычно гормоночувствительна, то есть ее рост зависит от тестостерона, и эффективна терапия, блокирующая андрогеновый рецептор. Но в процессе клональной эволюции внутри опухоли могут появляться субклоны с мутациями, позволяющими ускользать от действия препарата. Эти клоны начинают преобладать, вызывая прогрессирование заболевания, и рак переходит в кастрационно-резистентную форму. Для таких случаев ищут другие терапевтические мишени. Выявлено, что в этих опухолях часто встречаются мутации в генах BRCA1, BRCA2 и других генах, участвующих в репарации ДНК путем гомологичной рекомбинации (HRR). Изначально исследовали панель из 15 HRR-генов для назначения PARP-ингибиторов. Со временем стало ясно, что один из генов не имеет существенной клинической значимости и был исключен. Сейчас дискутируется, как оптимизировать перечень оставшихся 14 генов HRR для рака предстательной железы, чтобы он был достаточно полным, но не избыточным. Хорошая тенденция — включать в отечественные клинические рекомендации только методы и маркеры с доказанной клинической значимостью. Еще один важный момент, выявляемый благодаря расширению NGS-диагностики, — мультилокусные наследственные онкологические синдромы. Это когда у одного пациента обнаруживаются патогенные варианты, характерные для разных синдромов, например, Линча и Ли—Фраумени. Возникает вопрос, как вести такого пациента. В целом, можно сказать, что молекулярно-генетическая диагностика онкозаболеваний в России развивается динамично, соответствуя ведущим мировым направлениям и рекомендациям авторитетных международных профессиональных медицинских ассоциаций.